CRISPR-tutkimuksen juuret ovat eräässä luonnon pitkäaikaisimmista kilpavarusteluista. Bakteriofaageiksi kutsutut virukset pyrkivät tuhoamaan bakteereita, ja bakteerit puolestaan pyrkivät suojautumaan faageilta erilaisilla immuunijärjestelmillä.
Yksi näistä järjestelmistä on CRISPR (lyhenne sanoista clustered regularly interspaced short palindromic repeats). Se on bakteerin DNA:ssa oleva alue, johon tallennetaan palasia viruksen perimästä. Eräänlainen muisti siis.
Tutkijatohtori Ville Hoikkala Jyväskylän yliopistosta selittää tarkemmin, miten CRISPR-mekanismi toimii.
”Uuden virustartunnan sattuessa CRISPR-alue muutetaan DNA:sta lyhyiksi RNA-molekyyleiksi, niin sanotuksi opas-RNA:ksi. Opas-RNA hakeutuu faagin perimään kuin magneetti, ja johdattaa sinne solussa olevia DNA:n tuhoajaproteiineja. Proteiini kiinnittyy faagin perimään ja katkaisee sen.”
Hoikkala vertaa kansantajuisemmin proteiineja voimakkaaseen, mutta sokeaan vartijaan, jonka opas-RNA johdattaa paikalle poistamaan tunkeilijan.
Kun faagien olemassaolo havaittiin 1900-luvun alussa, tiedemiehet oivalsivat sen potentiaalin bakteeritautien hoidossa. Syntyi faagiterapia, jolla pyritään aseistamaan faageja tuhoamaan tauteja aiheuttavia bakteereita. Menetelmää käytettiin paljon etenkin Itä-Euroopassa, mutta antibiootit syrjäyttivät sen 1900-luvun puolivälissä.
Huoli antibiooteille vastustuskykyisten superbakteerien noususta on kuitenkin tuonut faagiterapian jälleen keskusteluun. Hoikkala uskoo, että tulevaisuudessa näitä kahta metodia käytetään rinta rinnan.
”Lomittain käyttämällä molempien tekniikoiden hyvät puolet saadaan esille. Myös antibiootteja löydetään jatkuvasti, eivätkä bakteerit tule automaattisesti kaikille vastustuskykyisiksi.”
Faagiterapian mahdollisia haittoja tutkitaan Hoikkalan mukaan jatkuvasti, mutta toistaiseksi hyödyt ovat haittoja suuremmat.
”Koska faagit ovat kehittyneet tartuttamaan nimenomaan tiettyjä bakteerisoluja, ei tarvitse pelätä, että ne tartuttaisivat ja lisääntyisivät omissa soluissamme.”
Faagiterapian mahdollisia haittoja tutkitaan Hoikkalan mukaan jatkuvasti, mutta toistaiseksi hyödyt ovat haittoja suuremmat.
CRISPR-tutkimus otti valtavan harppauksen vuonna 2012. Tuolloin ranskalainen Emmanuelle Charpentier ja yhdysvaltalainen Jennifer Doudna osoittivat, että Cas9-niminen tuhoajaproteiini toimii bakteerien lisäksi muissakin solutyypeissä, jolloin sitä voidaan käyttää ”geenisaksina” muokkaamaan perimää haluttuun suuntaan.
Menetelmä on ollut niin mullistava, että Doudnalle ja Charpentierille myönnettiin kemian Nobel-palkinto vuonna 2020.
Geenieditoinnilla on useita potentiaalisia käyttötarkoituksia. Ruokakasvit voidaan perimää muokkaamalla tehdä vastustuskykyisiksi sairauksille ja tuholaisille, mikä parantaa satoja. Hyttyset voidaan tehdä vastustuskykyisiksi malarialle ja denguekuumeelle. Näin ne eivät levitä tautia ihmisiin.
Menetelmää voidaan käyttää myös sairauksien hoitoon. Erityisen lupaavia tutkimustuloksia on saatu monogeenisten eli yhteen geenivirheeseen perustuvien sairauksien saralla.
Tällainen sairaus on esimerkiksi sirppisoluanemia. Siinä potilaan punasolut ovat epämuodostuneet, eivätkä kykene kuljettamaan tarpeeksi happea.
”Ihmisiä, joilla on jokin monogeeninen sairaus, on yli 250 miljoonaa. Eli potentiaali on valtava. Esimerkiksi näköön liittyvissä sairauksissa tutkimukset ovat jo hyvin pitkällä”, kertoo dosentti Topi Tervonen Helsingin yliopistosta.
Kliinisissä kokeissa on myös muokattu sirppisoluanemiaa sairastavien henkilöiden veren kantasoluja CRISPR:n avulla. Aiemmin potilaat ovat joutuneet käymään joka kuukausi verensiirrossa, sillä heidän omat punasolunsa eivät kuljeta riittävästi happea.
”Koehenkilöt ovat nyt eläneet 1,5 vuotta ilman verensiirtoja. Voidaan siis olla aika varmoja, että menetelmällä saadaan haluttu tulos. Siitä ei kuitenkaan voida olla vielä täysin varmoja, ettei haittavaikutuksia ole syntynyt”, kertoo perinnöllisten sairauksien lääkäri, tutkija Kirmo Wartiovaara.
”Vaarana on, että väsymättömät tappajasolut käyvät potilaan omien solujen kimppuun. Potilas voi saada hoidosta hyödyn syövän suhteen, mutta myöhemmin hänelle ilmestyy hoidon sivuvaikutuksena autoimmuunisairauksia.”
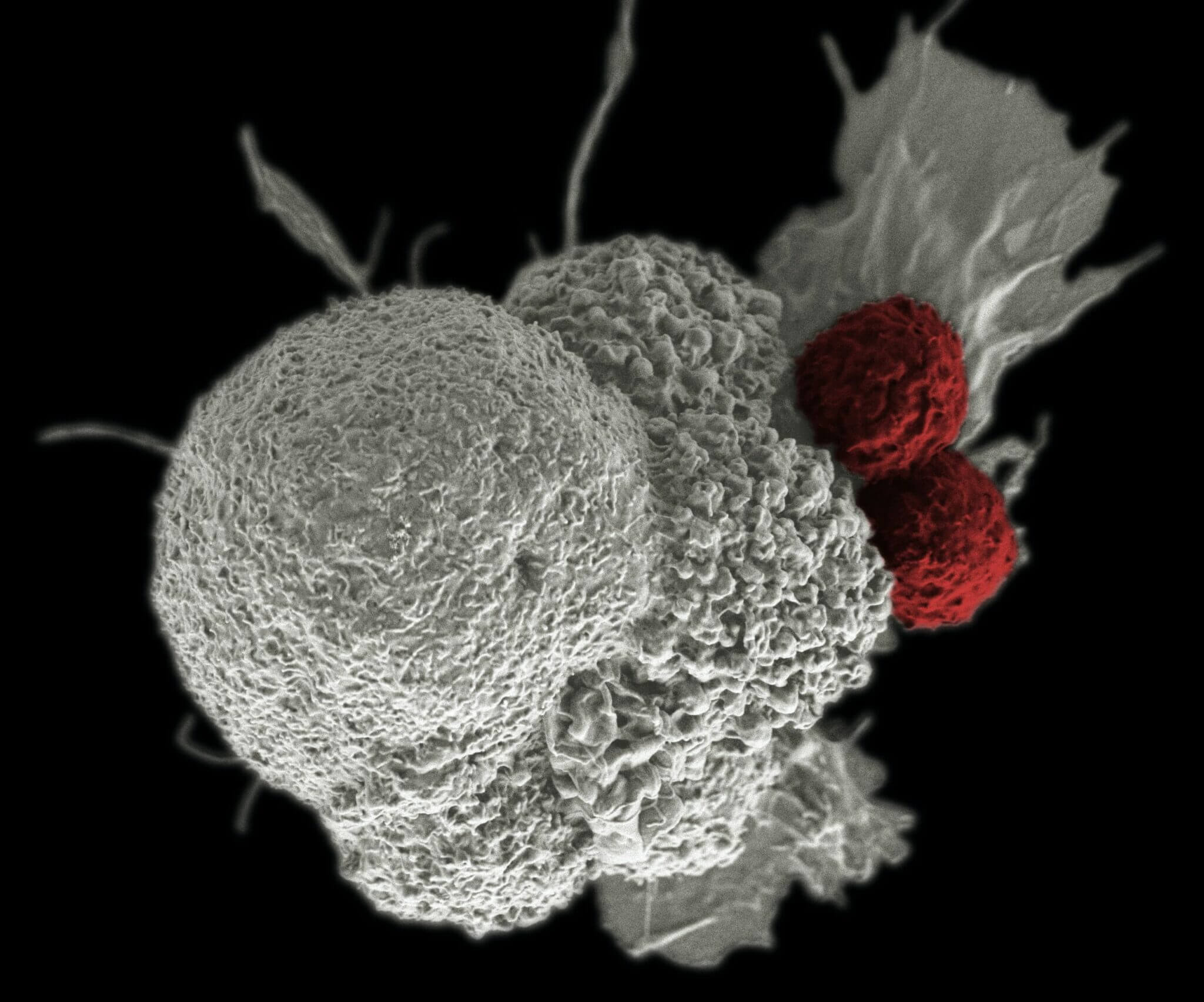
Myös syöpätutkimuksissa on saatu lupaavia tuloksia. Amerikkalaisessa tutkimuksessa kolmelta pitkälle edennyttä syöpää sairastaneelta potilaalta otettiin verestä T-soluja, jotka tuhoavat taudinaiheuttajia. Geenisaksilla soluilta poistettiin geeni, joka saa ne lamaantumaan jonkin ajan jälkeen. Sen jälkeen väsymättömiksi sotilaiksi muokatut solut palautettiin potilaiden verenkiertoon.
Kukaan kolmesta potilaasta ei saanut vakavia haittoja kokeesta, ja kahden potilaan sairauden eteneminen pysähtyi.
Syöpätutkija Juha Klefström näkee menetelmässä myös riskejä.
”Vaarana on, että väsymättömät tappajasolut käyvät potilaan omien solujen kimppuun. Potilas voi saada hoidosta hyödyn syövän suhteen, mutta myöhemmin hänelle ilmestyy hoidon sivuvaikutuksena autoimmuunisairauksia. Olisi keksittävä keino, jolla siirrännäiset tuhotaan, jos asiat eivät mene kuten halutaan.”
Riskien lisäksi geenien muokkaamiseen liittyy paljon eettisiä kysymyksiä. Jos perinnöllisiä sairauksia on tulevaisuudessa mahdollista hoitaa CRISPR:n avulla, olisiko muita perinnöllisiä ominaisuuksia muokaten mahdollista luoda niin sanottuja ”designer-lapsia”?
Vuonna 2018 kiinalainen He Jiankui järkytti tiedemaailmaa kertomalla, että hän oli muokannut kaksostyttöjen DNA:ta sikiövaiheessa. Myöhemmin paljastui, että He oli väärentänyt dokumentteja ja johtanut lääkäreitä harhaan voidakseen toteuttaa kokeen. Kaksosten vanhemmat eivät tienneet muokkauksesta ennen synnytystä.
Kansainvälinen tiedeyhteisö tuomitsi kokeen jyrkästi. Joulukuussa 2019 He tuomittiin Kiinassa kolmeksi vuodeksi vankilaan.
Kirmo Wartiovaara tuomitsee kokeen, ja kertoo olleensa huolestunut siitä, mitä tapaus tekee geenimuuntelun maineelle.
”Olisi voinut käydä niin, että maailman terveysviranomaiset tai tutkimuksen rahoittajat olisivat kieltäneet geenimuuntelun kokonaan. Onneksi näin ei käynyt, ja tutkimus pääsee eteenpäin.”
”Ennen kuin voi parantaa maailmaa, pitää tietää miten se toimii. Sama koskee solua.”
Geenieditointiin ei tällä hetkellä ole yhtenäistä kansainvälistä lainsäädäntöä, mutta eettisiä ohjeistuksia on annettu. Tutkimusta on sallittua tehdä, mutta perinnöllisiä muutoksia voidaan harkita vasta, kun kokeiden turvallisuudesta ollaan ehdottoman varmoja.
Wartiovaara ei pidä ajatusta designer-lapsista realistisena visiona.
”Ihmisen genomissa on kolme miljardia kirjainta, emmekä edes tiedä, mitä kirjainta muuttamalla saadaan haluttu vaikutus. Ja vaikka oikea kirjain tiedettäisiin, riski vakaviin haittavaikutuksiin on suuri. Menee todella kauan ennen kuin hyöty-haittasuhde on kohdallaan ihmisen perimän muokkaamiseen.”
Wartiovaara peräänkuuluttaa laadukasta perustutkimusta.
”Ennen kuin voi parantaa maailmaa, pitää tietää miten se toimii. Sama koskee solua.”
Vaikka geenieditointiin liittyy paljon haasteita ja eettisiä kysymyksiä, Juha Klefström näkee sen tulevaisuuden alana.
”Tekniikan myötä syntyy uusia työpaikkoja, ja diagnostiikan alueella on mahdollisuuksia innovoida ja perustaa yrityksiä. Seuraavan polven nuoria tutkijoita odotetaan innolla.”